吡咯替尼Ib期临床研究结果曾于2017年发表在JCO杂志,吡咯替尼联合治疗I期临床研究结果于2019年发表在Clinical Cancer Research杂志,II期研究结果再次发表JCO杂志。基于吡咯替尼联合治疗的较好疗效,徐兵河教授团队随后开展了III期PHOEBE研究。2020年ASCO会议期间,徐兵河教授以口头报告形式公布了III期PHOEBE研究结果。近日,PHOEBE研究中期分析结果全文发表于The Lancet Oncology杂志。

研究背景
吡咯替尼是一种耐受性良好的第二代不可逆泛 HER TKI,可靶向HER1、HER2和HER4。I期研究初步证实了吡咯替尼单药及联合卡培他滨在多线治疗进展后HER2+乳腺癌患者中的抗肿瘤活性。
在开放标签、多中心随机II期临床研究中,与拉帕替尼+卡培他滨相比,吡咯替尼+卡培他滨显著改善了经紫杉类+蒽环类±曲妥珠单抗治疗进展的HER2+晚期患者的客观缓解率(ORR)(78.5% vs 57.1%)和无进展生存期(PFS)(HR=0.36)。
吡咯替尼的耐受性良好。与其他HER2靶向药物类似,腹泻是吡咯替尼单药或联合卡培他滨时最常见的不良事件。大多数腹泻事件为1级或2级,3级事件发生率为10.7%~15.4%。无4级或5级腹泻事件报道。3级腹泻主要发生在治疗第一个周期,之后发生率逐渐下降。
基于此,2018年8月,国家药品监督管理局(NMPA)药品评审中心(CDE)批准吡咯替尼上市,用于HER2+晚期乳腺癌的治疗。
研究方法
PHOEBE是一项开放标签、在中国29个中心开展的III期随机对照研究。纳入组织学确认的HER2+晚期乳腺癌,年龄18~70岁,ECOG PS评分为0或1。入组患者在21天一周期的第1至14天连续接受吡咯替尼(400mg,每日一次)或拉帕替尼(1250mg,每日一次)+卡培他滨(1000mg/m2,每日两次)。中期分析显著性阈值,需P≤0.0066才能证明吡咯替尼优于拉帕替尼。主要终点为盲态独立中心(BICR)评估的PFS。
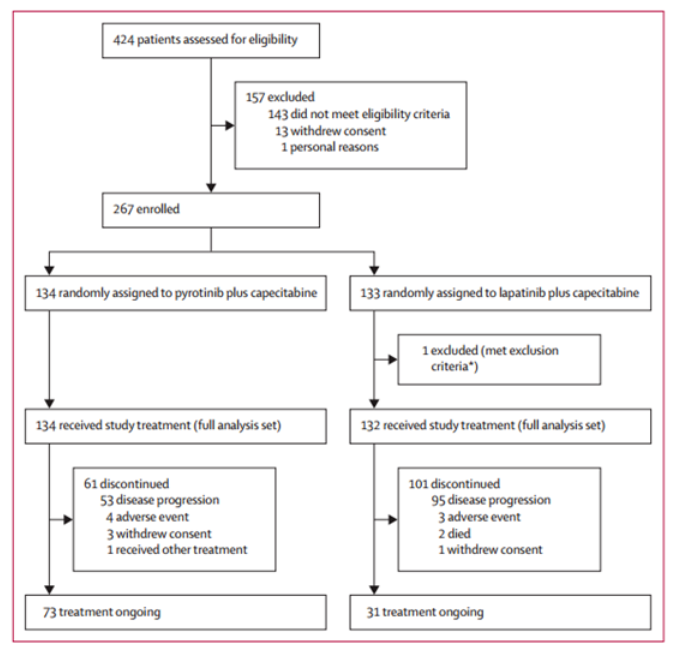
图1 试验流程图
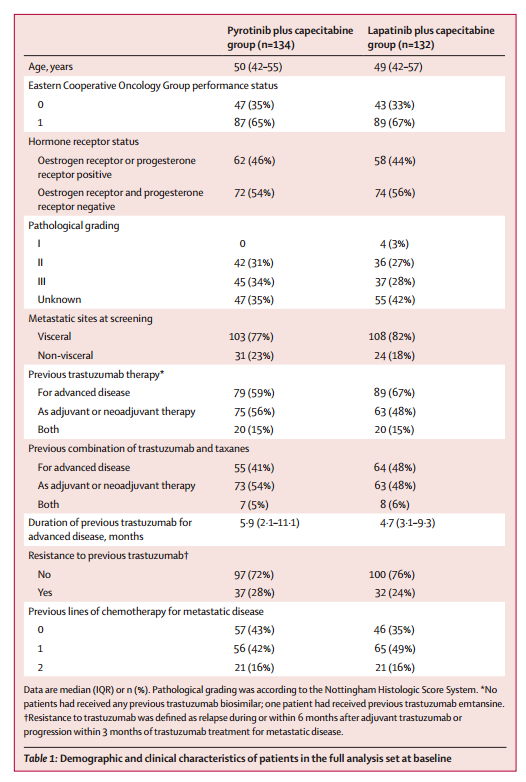
表1 患者基线特征
主要结果
2017年7月31日至2018年10月30日期间,共纳入267例患者并随机分配接受吡咯替尼+卡培他滨(n=133)或拉帕替尼+卡培他滨(n=134)治疗(图1,表1)。中期分析时间为2019年3月31日。吡咯替尼组和拉帕替尼组的中位随访时间分别为10.5个月和9.7个月,BICR评估的两组中位PFS分别为12.5个月和6.8个月(HR=0.39,单侧P<0.0001)(图2A)。研究者评估的中位PFS分别为11.0个月和5.6个月(HR=0.42,单侧P<0.0001)。
亚组分析显示出与总人群一致的PFS获益(图2B)。
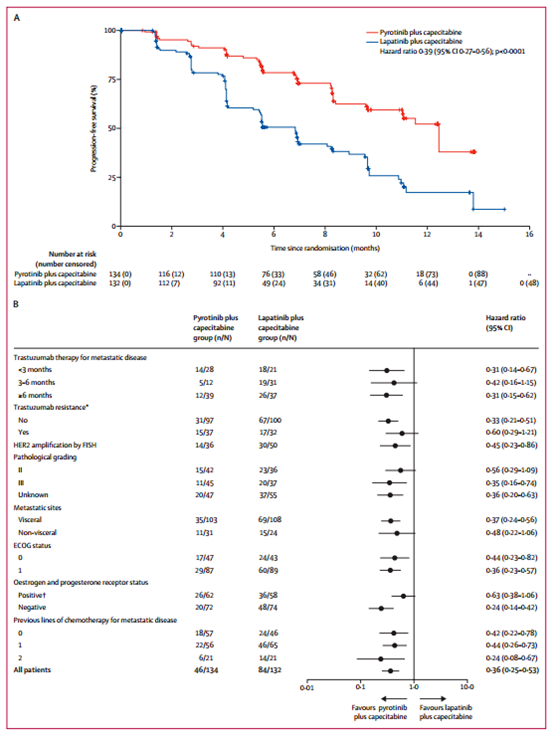
图2 PFS结果
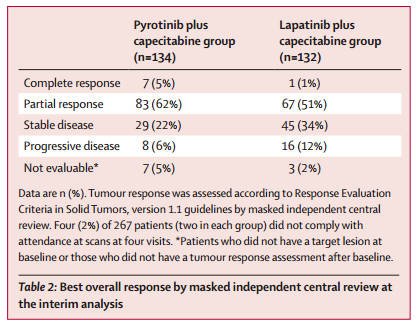
吡咯替尼组和拉帕替尼组的ORR分别为67%和52%(表2)。中期分析时,两组分别有70%和49%患者仍在缓解。预计两组的中位缓解持续时间(DOR)分别为11.1个月和7.0个月。
表2 疗效分析
讨论和结论
PHOEBE研究和III期EMILIA研究(T-DM1 vs 拉帕替尼+卡培他滨)均纳入经紫杉类和曲妥珠单抗治疗进展的HER2+晚期乳腺癌患者。EMILIA研究中,T-DM1同样改善了患者的PFS,T-DM1和拉帕替尼组的中位PFS分别为9.6个月和6.4个月(HR=0.65),ORR分别为44%和31%。T-DM1已成为HER2+晚期乳腺癌的二线标准治疗方案。PHOEBE研究显示,吡咯替尼+卡培他滨的疗效与T-DM1用于经曲妥珠单抗治疗进展患者的疗效相当。研究结果提示,在其他药物不可及情况下,吡咯替尼+卡培他滨是可替代的治疗选择。吡咯替尼+卡培他滨应考虑作为曲妥珠单抗和化疗进展后HER2+晚期乳腺癌患者的治疗选择。